밸리데이션 소개
생명과학(제약/바이오), 생물의 약품, 식품 및 화학공장, 반도체와 같은 제조 산업의 전문지식, 기술기반의서비스를 제공하고, IT 신기술 개발, 융합을 통하여 스마트 공장 기술을 선도하는 업체입니다.
| 규제 | 기관 | 주요 내용 |
|---|---|---|
| 완제의약품 제조 및 품질관리기준 가이던스 | 대한민국 식약처, 2018 |
별첨2. ‘컴퓨터화 시스템’ - 의약품 제조 및 품질관리 기준 업무에 사용 되는 모든 컴퓨터화 시스템 대상 - 응용 프로그램은 검증되어야 하고, 적격성 평가가 실시 되어야 함 - 컴퓨터화 시스템 되지 않은 작업을 컴퓨터화 할 경우 제품 품질, 공정관리 및 품질 보증 수준이 저하되어서는 안됨 |
| Data Integrity | PIC/S Guide Line, 2016 |
Attributable(기인성) - 기록 작업, 변경/삭제에 대한 작업에 대해 개인을 식별할 수 있어야 한다. Legible(가독성) - 전체 기록은 육안 판독이 가능해야 한다.(전자, 비전자 공통) Contemporaneous(동시성) - 모든 기록은 사건, 결정이 발생된 시점에 기록되어야 한다. Original(원본성) - 전자 또는 서면 문서는 모두 일차적으로 포착된 동적 상태의 정보가 유지되어야 한다. Accurate(정확성) - 품질과 관련된 결과 기록은 정확하다는 것을 보장해야 한다. |
| Annex 11 | EU GMP, 2008 |
Vendor Audit - 소프트웨어가 품질 시스템에 따라 제조되었는지 확인한다. Access control - 사용자나 암호를 이용한 관리가 요구된다. Change History of Data - 변경이력과 변경사유가 요구(audit trail)된다 Security of Data - 장비 데이터는 고의나 우발적인 위험에 대하여 안전해야 한다. Backup of Data - 데이터의 정기적 백업이 요구된다. |
| 21 CFR Part 11 | FDA, 1997년 |
Electronic Record - 전자기록을 생성, 변형, 유지 또는 전송하는 경우 전자 기록의 신빙성, 완전성에 대한 기밀 유지를 보장해야 하며 서명자가 서명한 기록이 필수 |
대응 전략
-
STEP 01Validation Plan 단계
-
초기 영향 평가
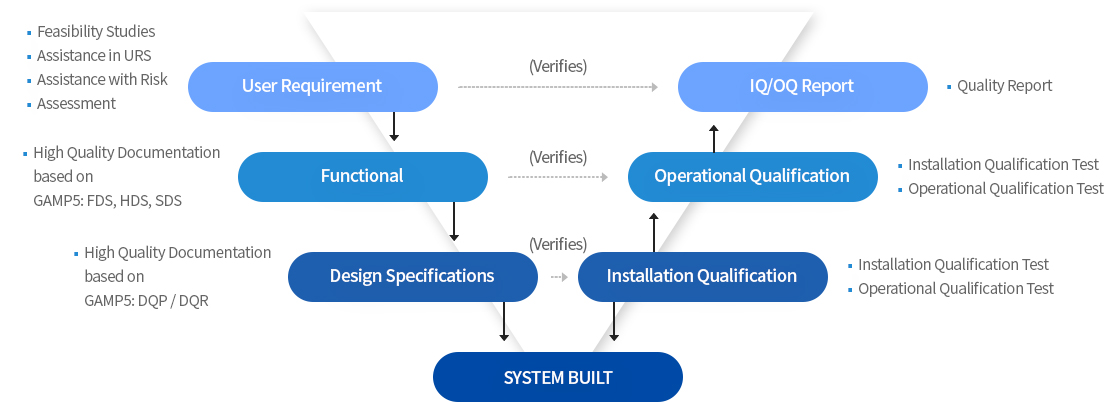
ISPE Guideline에서 제시하는 Initial Risk Assessment 항목에 따른 “Determination of System Impact” 정의함으로써 관련 시스템의 밸리데이션 수행 근거를 마련한다.
-
초기 영향 평가
-
STEP 02 Specification 단계
-
URS Risk Assessment
생성된 URS에 대한 위험 평가를 통해 현 규제기관에서 요구하는 프로제트 단계에서의 밸리데이션 수행 및 데이터 무결성(전자기록) 부합 여부를 확인하고, 해당 요구항목들의 보완 및 이후 밸리데이션 수행단계에서의 검증범위를 정의 한다.
-
Functional Risk Assessment
공급사 설계문서에 대한 각 구성요소별 위험 시나리오를 도출하여 해당 위험에 대한 순위를 결정하고, 순위에 따른 위험 감소대책을 제시한다.
-
URS Risk Assessment
-
STEP 03 Test 단계
-
URS Risk Assessment
데이터 무결성 및 시스템 기능에 대한 완전성 관련 기준에 따른 테스트 시나리오를 도출하여 규제기관에서 요구하는 기준을 부합하는지 증명한다.
-
URS Risk Assessment
-
STEP 04 Test 단계
-
Validation Report 단계
IQ/OQ 수행 완료 이후, 규격단계에서 정의되었던 위험 및 순위가 밸리데이션 수행을 통해 해당 위험이 제거 및 수용가능한 수준으로 완화되었는지 확인한다.
-
Validation Report 단계
Validation Life Cycle